LEYES DE LOS GASES.
- INTRODUCCIÓN:
Los gases se forman cuando la energía de un sistema excede todas las fuerzas de atracción entre moléculas. Así, las moléculas de gas interactúan poco, ocasionalmente chocándose. En el estado gaseoso, las moléculas se mueven rápidamente y son libres de circular en cualquier dirección , extendiéndose en largas distancias. A medida que la temperatura aumenta, la cantidad de movimiento de las moléculas individuales aumenta. Los gases se expanden para llenar sus contenedores y tienen una densidad baja. Debido a que las moléculas individuales están ampliamente separadas y pueden circular libremente en el estado gaseoso, los gases pueden ser fácilmente comprimidos y pueden tener una forma indefinida.
- OBJETIVOS:
- Explicar las propiedades de los gases ideales y las diferentes leyes que rigen su comportamiento.
- Conocer las leyes de los gases.
- Aprender las fórmulas de cada una de estas leyes.
- Demostrar que conoce y aplica el conocimiento de las leyes de boyle, charles y de los gases ideales en la solución de ejercicios.
- Reconocer las propiedades que poseen los gases.
- Aplicar las diferentes leyes.
- PROCEDIMIENTO:
Primero ingrese a la página http://www.educaplus.org/gases/index.html . Donde realizare aquí un proceso el cual consiste en estudiar la pagina y sus diferentes leyes, también realizare las actividades indicadas.
ESTADO SOLIDO:
Los sólidos se caracterizan por tener forma y volumen constantes. Esto se debe a que las partículas que los forman están unidas por unas fuerzas de atracción grandes de modo que ocupan posiciones casi fijas.
En el estado sólido las partículas solamente pueden moverse vibrando u oscilando alrededor de posiciones fijas, pero no pueden moverse trasladándose libremente a lo largo del sólido.
Las partículas en el estado sólido propiamente dicho, se disponen de forma ordenada, con una regularidad espacial geométrica, que da lugar a diversas estructuras cristalinas.
ESTADO LÍQUIDO:
Los líquidos, al igual que los sólidos, tienen volumen constante. En los líquidos las partículas están unidas por unas fuerzas de atracción menores que en los sólidos, por esta razón las partículas de un líquido pueden trasladarse con libertad. El número de partículas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas.
Así se explica que los líquidos no tengan forma fija y adopten la forma del recipiente que los contiene. También se explican propiedades como la fluidez o la viscosidad.
ESTADO GASEOSO:
Los gases, igual que los líquidos, no tienen forma fija pero, a diferencia de éstos, su volumen tampoco es fijo. También son fluidos, como los líquidos.
En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño.
Las partículas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y compresibilidad que presentan los gases: sus partículas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen en que se encuentra confinado un gas éste pasará a estado líquido.
TEMPERATURA:
Mide la intensidad de calor cuando se aplican las leyes de los gases ideales la temperatura centígrados debe convertirse a la escala absoluta que es la temperatura kelvin (c-k)
Para lo cual se tienen en cuenta propiedades como la dilatación térmica. la temperatura de los gases generalmente se mide en grados centígrados (co ) o grados celsius cuando se usan las leyes de los gases ideales, la temperatura centígrados se debe convertir a la escala absoluta o temperatura kelvin, de acuerdo con la siguiente relación:
K = 273 + co
| Nombre | Símbolo | Temperaturas de referencia | Equivalencia |
| Escala Celsius | ºC | Puntos de congelación (0ºC) y ebullición del agua (100ºC) | |
| Escala Fahrenhit | ºF | Punto de congelación de una mezcla anticongelante de agua y sal y temperatura del cuerpo humano. | ºF = 1,8 ºC + 32 |
| Escala Kelvin | K | Cero absoluto (temperatura más baja posible) y punto triple del agua. | K = ºC + 273 |
PRESIÓN:
Es la fuerza ejercida por unidad de área, en química se expresa en atmósferas, en ml de mercurio o torr.
P = F = Fuerza que actúa perpendicularmente a una superficie
A área en la que está distribuida la fuerza
Presión ( en N/m2) = fuerza (en newton)
Área ( en m2)
En química, para expresar presiones de gases, se usa la atmósfera estándar y el milímetro de mercurio o torr.
Los gases por tener peso, producen presiones sobre los cuerpos, de modo que estas presiones se manifiestan en todas las direcciones. A la presión que actúa sobre los cuerpos existentes en la tierra por estar en la atmósfera la denominamos presión atmosférica . Se origina del peso del aire que la forma.
VOLUMEN:
Es el espacio ocupado por un cuerpo. la unidad del sistema ingles es el (m3) pero como es una unidad bastante grande usaremos el ( cm3 ) o el (ml) .
En un gas ideal , el producto PV dividido por nT es una constante, la constante universal de los gases ,R, el valor de R depende de las unidades utilizadas para P , V, n , T. a presiones suficientemente altas se ha demostrado que todos los gases obedecen las leyes de boyle, charles y gaylussac; las cuales relacionan el volumen de un gas con la presión y la temperatura.
CANTIDAD DE GAS:
ACTIVIDADES:
1.- Rellena los datos con la ayuda del simulador
()
H2
|
CH4
|
Cl2
|
I2
|
|
moles
|
15 mol
|
8.3 mol
|
7.5 mol
|
3 mol
|
masa matraz vacío
|
175.0g
|
175.0g
|
175.0g
|
175.0g
|
masa matraz + gas
|
205.0g
|
307.8g
|
707.5g
|
93604g
|
masa sólo gas
|
30g
|
132.8g
|
532.5g
|
761.4g
|
masa molar
|
2g/mol
|
16g/mol
|
71g/mol
|
253.8g/mol
|
2.- Redacta un pequeño informe explicando la
estrategia que has seguido para realizar las pesadas.
R/: Lo primero que realice fue pesar la masa matraz vacía con ayuda del
simulador, que nos dio 175 g, de ahí pesamos cada matraz por separado; para
continuar en el siguiente de “MASA SOLO GAS” pusimos cada matraz por separado y
le restamos 175 que es el valor que corresponde el matraz para dejar solo el
gas de cada elemento.
3.- ¿Cuántas moléculas hay en cada matraz?
número de moléculas
|
|
matraz vacío
|
0
|
matraz con 15 mol de H2
|
30
|
matraz con 8.3 mol de CH4
|
41.5
|
matraz con 7.5 mol de Cl2
|
22.5
|
matraz con 3 mol de I2
|
6
|
4.- ¿Cuántos átomos hay en cada matraz?
número de átomos
|
|
matraz vacío
|
0
|
matraz con 15 mol de H2
|
1.8066
x 10^25
|
matraz con 8.3 mol de CH4
|
2.49913
x 10^25
|
matraz con 7.5 mol de Cl2
|
1.35495
x 10^25
|
matraz con 3 mol de I2
|
3.6132
x 10^25
|
5.- ¿Cuál es el matraz que contiene más
hidrógeno?
átomos de H
|
|
matraz con 15 mol de H2
|
|
matraz con 8.3 mol de CH4
|
x
|
LEYES
LEY DE BOYLE:
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión: 

donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. El valor exacto de la constante k no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
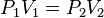
Además se obtiene despejada que:




Donde:
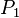 = Presión Inicial
= Presión Inicial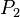 = Presión Final
= Presión Final = Volumen Inicial
= Volumen Inicial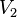 = Volumen Final
= Volumen Final
Esta Ley es una simplificación de la Ley de los gases ideales particularizada para procesos isotermos.
EJEMPLO: Tenemos 4 L de un gas que están a 600 mmHg de presión. ¿Cuál será su volumen si aumentamos la presión hasta 800 mmHg? La temperatura es constante, no varía.
SOLUCIÓN:
Como los datos de presión están ambos en milímetros de mercurio (mmHg) no es necesario hacer la conversión a atmósferas (atm). Si solo uno de ellos estuviera en mmHg y el otro en atm, habría que dejar los dos en atm.
Aclarado esto, sustituimos los valores en la ecuación P 1 V 1 = P 2 V 2 .
Ponemos a la izquierda el miembro con la incógnita
Despejamos V 2 :
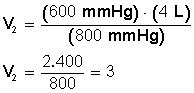
RESPUESTA:
Si aumentamos la presión hasta 800 mmHg el volumen disminuye hasta llegar a los 3 L.
LEY DE CHARLES
La Ley de Charles es una ley de los gases que relaciona el volumen y la temperatura de una cierta cantidad de gas a presión constante.
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
- Si la temperatura aumenta el volumen aumenta.
- Si la temperatura disminuye el volumen disminuye.
EJEMPLO: Un gas cuya temperatura llega a 25° C tiene un volumen de 2,5 L. Para experimentar, bajamos la temperatura a 10° C ¿Cuál será su nuevo volumen?
SOLUCIÓN:
El primer paso es recordar que en todas estas fórmulas referidas a la temperatura hay que usar siempre la escala Kelvin.
Por lo tanto, lo primero es expresar la temperatura en grados Kelvin:
Por lo tanto, lo primero es expresar la temperatura en grados Kelvin:
T 1 = (25 + 273) K= 298 K
T 2 = (10 + 273 ) K= 283 K
Ahora, sustituimos los datos en la ecuación:
Ahora, despejamos V 2 :
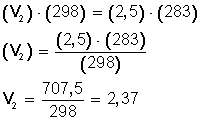
RESPUESTA:
Si bajamos la temperatura hasta los 10º C (283º K) el nuevo volumen del gas será 2,37 L.
LEY DE GAY-LUSSAC
La Ley de Gay-Lussac es una ley de los gases que relaciona la presión y la temperatura a volumen constante.
En 1802 Gay-Lussac descubrió que a volumen constante, la presión del gas es directamente proporcional a su temperatura (en grados Kelvin): P = k · T (k es una constante).
En 1802 Gay-Lussac descubrió que a volumen constante, la presión del gas es directamente proporcional a su temperatura (en grados Kelvin): P = k · T (k es una constante).
- Si la temperatura aumenta la presión aumenta.
- Si la temperatura disminuye la presión disminuye.
EJEMPLO: Cierto volumen de un gas se encuentra a una presión de 970 mmHg cuando su temperatura es de 25.0°C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg?
SOLUCIÓN:
Lo primero que debemos hacer es convertir los 25º C a grados Kelvin:
T 1 = (25 + 273) K= 298 K
Ahora sustituimos los datos en la ecuación:
Ahora despejamos T 2 :
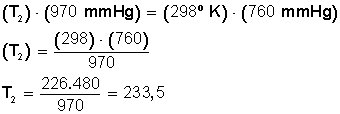
RESPUESTA:
La temperatura debe bajar hasta los 233,5º Kelvin. Si convertimos estos grados en grados Celsius hacemos
233,5 − 273 = −39,5 °C.
233,5 − 273 = −39,5 °C.
LEY DE CHARLES
- Ejercicio 1:
LEY DE LOS GASES IDEALES
- Ejercicio 1:
SALA DE BOYLE:
SALA DE CHARLES:
- WEBGRAFÍA:
- http://www.educaplus.org/gases/index.html
- http://www.quimicas.net/2015/05/ejemplos-de-la-ley-de-gay-lussac.html
- http://www.quimicas.net/2015/05/ejemplos-de-la-ley-de-charles.html
- http://aprendequimica.blogspot.com.co/2010/10/ley-de-boyle.html
- https://es.wikipedia.org/wiki/Gas
- http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/estados/gas.htm
- http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/estados/liquido.htm
- http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/estados/solido.htm
- BIBLIOGRAFÍA:
- Cuaderno de química.
- CONCLUSIONES:
- Finalizo diciendo que esta actividad online es muy interesante ya que por medio de esta herramientas aprendemos conceptos de cada una de las leyes de los gases, y sus respectivas formulas donde las explican fácilmente y terminan dando un ejemplo, así se me facilita aprender estos temas.
- Por medio de este laboratorio comprendí que la química es un factor muy importante e nuestras vidas, ya que nos ayuda en un futuro, y poner en practica estos conocimientos.
- Gracias a este laboratorio me di cuenta que este tema es muy fácil siempre y cuando prestemos atención en todas las clases dictadas.



































DONDE ESTÁN LOS EJERCICIOS? 3.3
ResponderBorrar